Die Zulassung von Arzneimitteln innerhalb der EU erfordert eine Umweltrisikobewertung (Environmental Risk Assessment, ERA) für den oder die enthaltenen Wirkstoffe. Das Ziel der Umweltrisikobewertung besteht darin, potenziell nachteilige Auswirkungen auf die Umwelt und die öffentliche Gesundheit zu bewerten und zu begrenzen. Als Modul 1.6.1 (für non-GMOs) ist ein ERA Bestandteil des Zulassungsdossiers.
Seit 01.09.2024 ist die aktuelle Leitlinie (EMEA/CHMP/SWP/4447/00 Rev. 1-Corr.) in Kraft. Sie stellt eine deutliche Erweiterung der zuvor gültigen Leitlinie dar, indem z.B. die Risiken antimikrobieller Resistenzen, kritischer Wirkstoffe (wie endokrin wirksame Substanzen und Antiparasitika) und einer Anreicherung über die Nahrungskette zu berücksichtigen sind. Es ist davon auszugehen, dass mit der Überarbeitung der Arzneimittelrichtlinie eine weitere Verschärfung der Anforderungen an die Umweltrisikobewertung erfolgen wird.
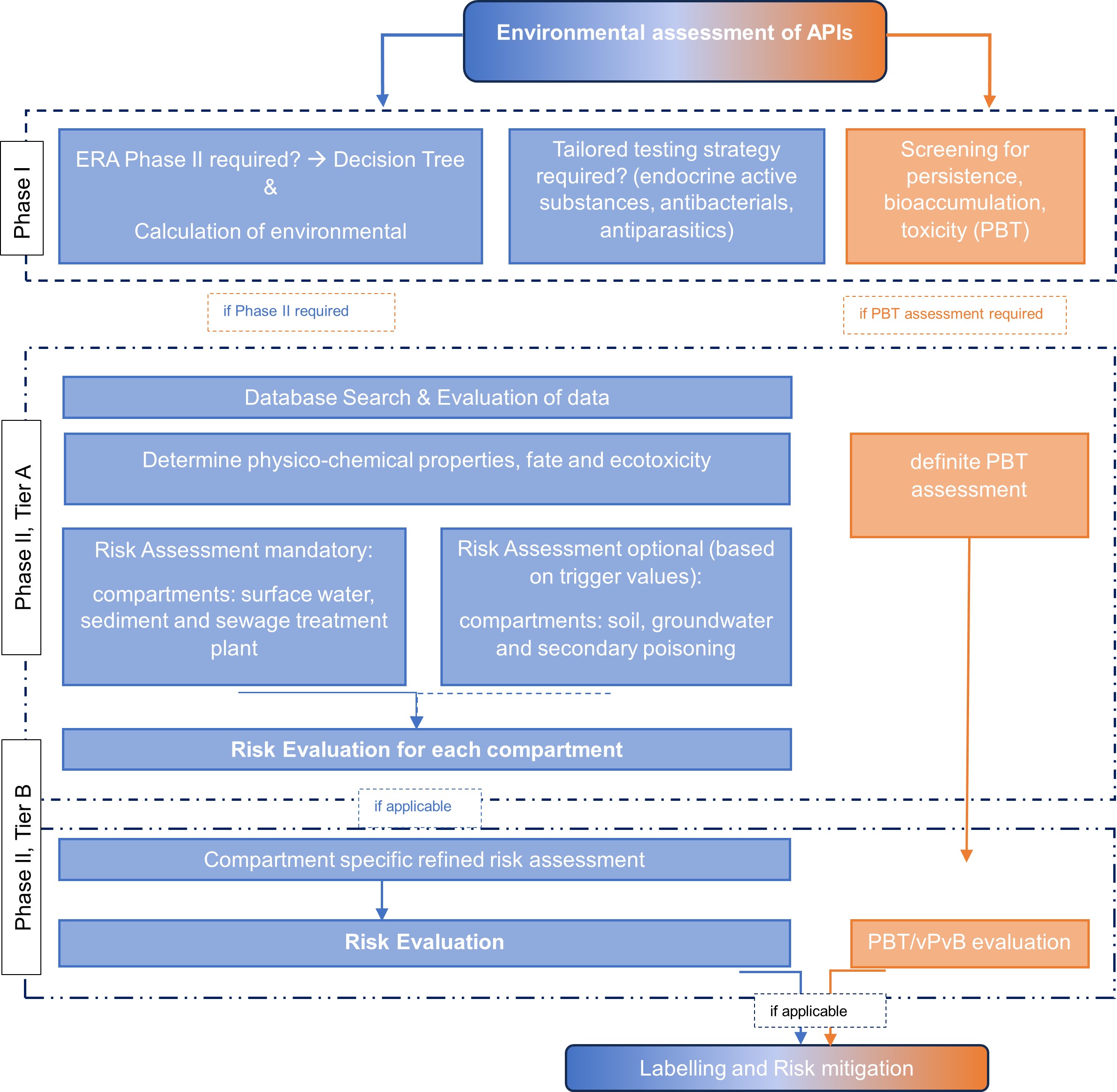
Die Vorgehensweise eines ERA anhand eines Fließdiagramms ist nachfolgend dargestellt:
Unsere Leistungen
Wir unterstützen Sie bei der Erstellung eines umfassenden ERA-Moduls 1.6.1 für Humanarzneimittelmittel basierend auf Literaturdaten bzw. experimentellen Studien:
- Prüfung auf Notwendigkeit und Umfang eines ERA
- Anfrage von Originatordaten
- Umfassende Datenbankrecherche nach Anforderungen der neuen Leitlinie
- Bewertung vorhandener Literaturdaten auf Relevanz (CRED-Methode)
- Datenlückenanalyse und Entwicklung Teststrategie, ggf. mit Austausch der Behörde
- Studieninitiierung und Studienmonitoring abgestimmt auf ERA-Anforderungen
- Erstellung M1.6.1
- Kommunikation mit Behörde
Aufgrund unserer engen Zusammenarbeit mit verschiedenen zertifizierten Testlaboren, bieten wir Ihnen das komplette Paket aus einer Hand (Überblick ERA Services).
Außerdem schulen wir Sie 2x jährlich in unserem praxisorientierten Weiterbildungsseminar!
Kontaktieren Sie uns für weitere Informationen:
Bianca Leubner
Tel.: +49 (0) 341 223 292 36
bianca.leubner@aca-pharma.eu

